Blog
Rationalisation de l'autorisation des noms pharmaceutiques : Examen unifié des marques et de la réglementation
- Solutions pour les marques
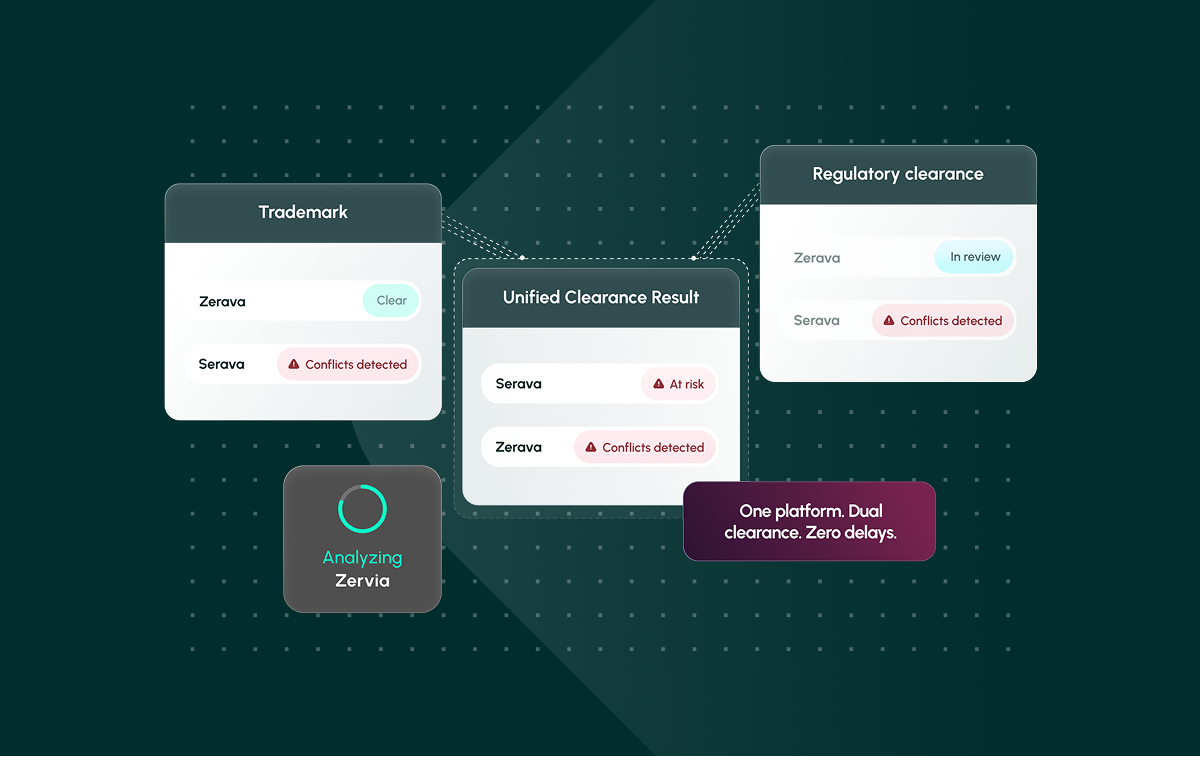
Une seule plate-forme. Double autorisation. Aucun retard. Découvrez comment Corsearch Pharma rationalise l'autorisation des noms pharmaceutiques.
Il n'a jamais été facile de donner un nom à une marque pharmaceutique. Les autorités de réglementation exerçant une surveillance plus étroite et les lancements devenant plus compétitifs, le risque qu'un nom échoue à un stade avancé du processus est plus élevé que jamais.
Ce blog explore les doubles défis auxquels les équipes sont confrontées, les raisons pour lesquelles les approches fragmentées traditionnelles multiplient les risques et les reprises, et la manière dont une stratégie unifiée peut aider les entreprises à protéger leur chiffre d'affaires, à accélérer les délais de mise sur le marché et à garantir la sécurité des patients.
Le défi de la double peine
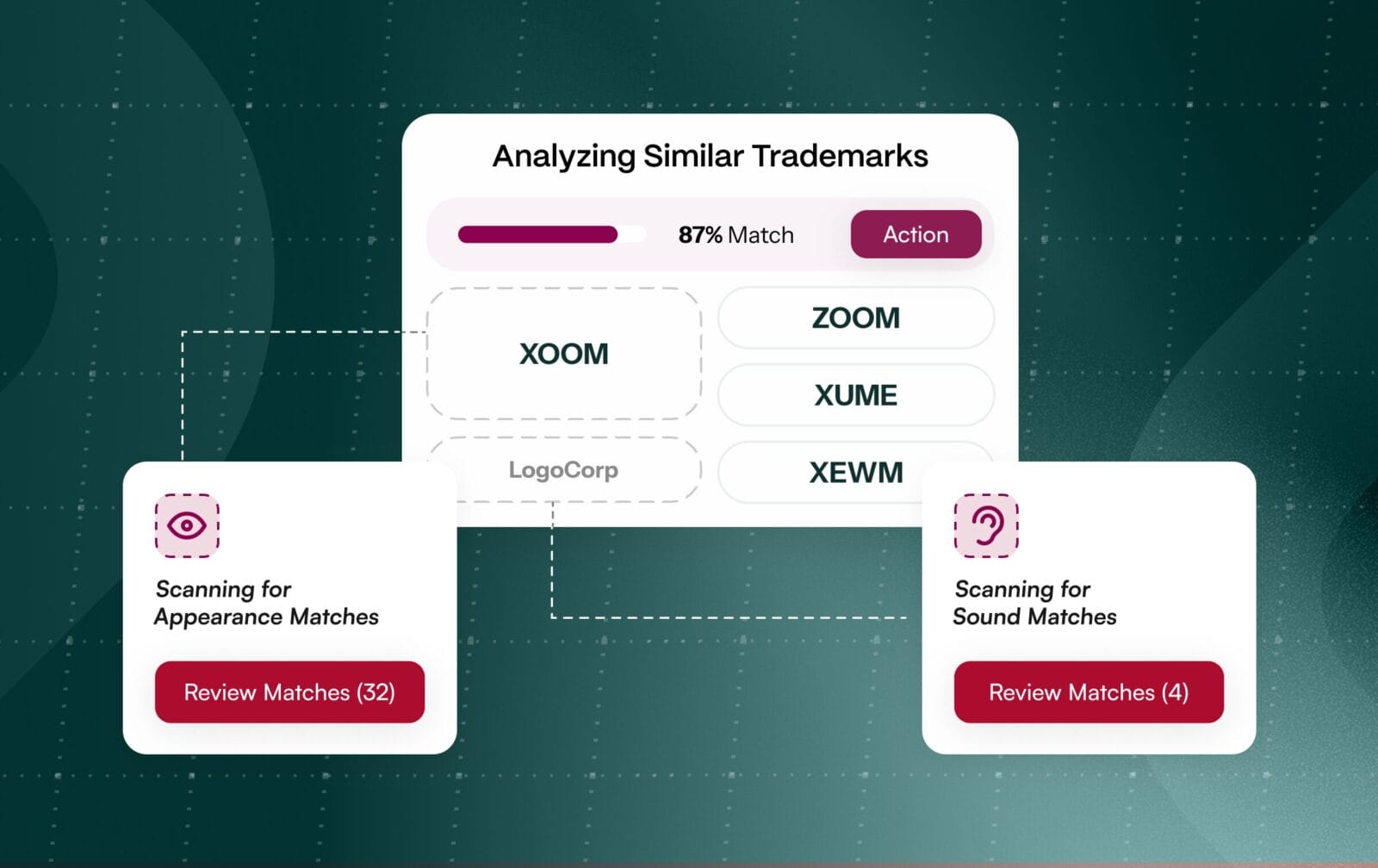
La désignation d'une marque pharmaceutique n'est pas une tâche linéaire. Elle implique deux examens parallèles aux enjeux considérables. Les équipes juridiques doivent approuver les marques déposées au niveau mondial, tandis que les équipes réglementaires examinent les noms à la recherche de risques pour la sécurité des patients, tels que la confusion par ressemblance ou par son (LASA). Les autorités réglementaires évaluent explicitement la similarité phonétique et orthographique en utilisant la méthodologie POCA de la FDA aux États-Unis et des critères comparables dans l'UE, ce qui signifie qu'un nom peut passer les contrôles juridiques tout en échouant sur le plan de la sécurité.
Le fait de les traiter comme des projets distincts et séquentiels multiplie les risques et les reprises. Les équipes découvrent souvent des conflits à un stade tardif du processus, ce qui oblige à des changements de marque coûteux ou retarde les lancements. Une meilleure solution consiste à unifier les marques et les autorisations réglementaires dès le premier jour, ce qui permet aux équipes interfonctionnelles de collaborer sur la même liste de candidats et de repérer rapidement les noms à haut risque. [1]
Le coût de la fragmentation : efforts redondants, lancements retardés, changements de marque
La gestion des marques et des autorisations réglementaires sur des systèmes différents oblige les équipes à dupliquer les recherches, à rapprocher les données manuellement et à procéder à des itérations tardives lorsque des conflits apparaissent. Ces retards sont coûteux. Des analyses indépendantes estiment que chaque jour de retard coûte entre 0,5 et 0,8 million de dollars en ventes non réalisées sur ordonnance pour les principales thérapies[2], tandis que des recherches plus larges utilisent le chiffre de 1 million de dollars par jour pour les implications du lancement[3]. [Les petits retards se répercutent en cascade sur les pertes de revenus et les fenêtres de marché manquées.
En combinant les vérifications juridiques et réglementaires dans une seule interface, les organisations peuvent éliminer les efforts redondants, accélérer la prise de décision et réduire l'exposition au risque réglementaire et au risque lié à la marque.
Pourquoi les cas de "légalité réussie, sécurité échouée" sont-ils fréquents ?
Les examinateurs réglementaires testent activement le risque de LASA à l'aide de POCA et de listes de contrôle structurées dans des bases de données de référence de médicaments telles que Drugs@FDA et RxNorm. Les noms qui ressemblent ou sonnent comme des produits existants, même s'ils sont distincts de la marque, doivent être rejetés afin de protéger les patients contre les erreurs de médication[4]. L'OMS et les autorités de réglementation signalent régulièrement les LASA comme une menace persistante pour la sécurité[5]. [5]
L'intégration de la notation alignée sur POCA et de l'intégration des données réglementaires dans le processus d'autorisation permet aux équipes de détecter les conflits potentiels dès le premier passage. En reproduisant les contrôles de similarité structurés utilisés par les examinateurs de la FDA et de l'EMA, les entreprises peuvent éliminer de manière proactive les noms non conformes, réduisant ainsi la probabilité de surprises à un stade avancé et de reprises coûteuses.
Le volume et la saturation amplifient le risque
La plupart des programmes de dénomination génèrent des centaines, voire des milliers de candidats avant que quelques-uns d'entre eux ne survivent jusqu'à la soumission. En l'absence de données intégrées et d'automatisation, les équipes perdent des cycles à examiner des noms qui, en fin de compte, échoueront en raison de leur similarité réglementaire ou des signaux de sécurité. Chaque candidat supplémentaire augmente la complexité des examens et la probabilité de conflits manqués. [6]
Une approche de filtrage à haut volume pilotée par l'IA aide les équipes à se concentrer sur les candidats les plus prometteurs, en réduisant les efforts gaspillés et en libérant des ressources pour des décisions créatives et stratégiques à plus forte valeur ajoutée.
A quoi ressemble "l'unifié" et pourquoi il gagne
Une plateforme moderne, basée sur l'IA, devrait rassembler tous les ensembles de données pertinents pour l'autorisation des noms pharmaceutiques : les registres des marques, le droit commun, les données de domaine et les sources des régulateurs, notamment l'Orange Book, Drugs@FDA, RxNorm et les orientations de l'EMA.
Les méthodes alignées sur les régulateurs sont intégrées de manière native, y compris la notation de similarité de type POCA et l'heuristique LASA, de sorte que les conflits potentiels sont signalés dès le premier passage de filtrage. Le triage piloté par l'IA regroupe les candidats qui se ressemblent et ceux qui ont la même apparence, en les classant par ordre de priorité en fonction du risque, afin de rationaliser les examens et de réduire les rapprochements manuels.
Enfin, les résultats doivent être normalisés dans un rapport unique et exportable auquel les équipes juridiques, réglementaires et marketing peuvent se fier. La collaboration, l'annotation et les preuves prêtes à l'audit aident les organisations à passer de l'espoir d'une autorisation à une confiance rapide, une capacité offerte par Corsearch Pharma, qui réunit l'autorisation de marque et l'autorisation réglementaire dans une plateforme unique et intégrée.
Des résultats commerciaux quantifiables
En utilisant Corsearch Pharma, les équipes juridiques, réglementaires et marketing peuvent obtenir des améliorations mesurables en termes d'efficacité des autorisations, de réduction des risques et d'économies.
Moins de rejets tardifs grâce à la résolution simultanée des conflits juridiques et réglementaires, ce qui réduit les boucles de "retour à la création" qui entraînent des coûts de changement de marque et font déraper les calendriers.
Prise de décision plus rapide grâce à l'élimination des recherches en double et des rapprochements manuels. Chaque jour économisé protège les revenus (fourchette récente : 0,5 à 0,8 million de dollars par jour en ventes d'ordonnances non réalisées). [2]
Réduire le coût total de la dénomination en éliminant plus tôt les projets non retenus et en réduisant les cycles d'examen externe et les risques de litige après le lancement.
Comment rendre opérationnelle une approche unifiée ce trimestre ?
Les équipes peuvent mettre en œuvre un flux de travail unifié et efficace dès le premier jour avec Corsearch Pharma, garantissant que les marques et les autorisations réglementaires sont alignées et exploitables.
Commencer à unifier dès l'admission : Effectuez des vérifications de conflits de marques et de similitudes alignées sur POCA sur la même liste de candidats et classez-les en fonction du risque composite.
Passerelle avec des critères partagés : Aligner les seuils légaux et réglementaires sur les meilleures pratiques de la FDA et les directives de l'EMA afin que les équipes interfonctionnelles trient sur la base de preuves identiques. [4]
Instrumenter la boucle : Suivre la durée du cycle, de l'idéation à la présélection. Quantifier les jours gagnés et les noms rejetés évités pour démontrer le retour sur investissement à la direction. Utilisez le temps gagné multiplié par le revenu quotidien à risque pour modéliser l'impact. [2]
Rendre l'autorisation des noms pharmaceutiques plus rapide et plus sûre
La dénomination des produits pharmaceutiques n'est pas seulement un problème de marque ou de réglementation. Il s'agit des deux à la fois. Les processus fragmentés garantissent une reprise du travail. Corsearch Pharma est la première solution sectorielle à unifier la marque et l'autorisation réglementaire au sein d'une plateforme unique, permettant aux équipes juridiques, réglementaires et marketing de protéger le chiffre d'affaires, la sécurité des patients et l'investissement créatif tout en accélérant les lancements.
Avec une notation POCA flexible, des données réglementaires intégrées, un filtrage assisté par l'IA et des fonctions de collaboration adaptées aux environnements réglementés, les équipes peuvent passer rapidement de l'espoir d'une autorisation à la confiance.
Parlons-en
Découvrez ce que Corsearch Pharma peut faire pour vous. Parlez à l'un de nos experts et assistez à une démonstration adaptée aux besoins de votre équipe pharmaceutique.
Références
[1] U.S. Food and Drug Administration, Best Practices in Developing Proprietary Names for Human Prescription Drug Products, 2020, https://www.fda.gov/regulatory-information/search-fda-guidance-documents/best-practices-developing-proprietary-names-human-prescription-drug-products-guidance-industry
[2] Applied Clinical Trials Online, How Much Does a Day of Delay in a Clinical Trial Really Cost, Tufts CSDD, 2024, https://www.appliedclinicaltrialsonline.com/view/how-much-does-a-day-of-delay-in-a-clinical-trial-really-cost-
[3] Université du Texas à Austin, Benchmarking the Cost of Delayed Drug Launches, 2023, https://repositories.lib.utexas.edu/bitstreams/5306e329-39d9-4af3-8b37-9f46000e3112/download
[4] U.S. Food and Drug Administration, Phonetic and Orthographic Computer Analysis (POCA) Program, 2024, https://www.fda.gov/drugs/resources-drugs/phonetic-and-orthographic-computer-analysis-poca-program
[5] Organisation mondiale de la santé, Sécurité des médicaments à présentation et à consonance semblables, 2023, https://www.who.int/publications/i/item/9789240058897
[6] U.S. Food and Drug Administration / European Medicines Agency, Guidance on Aligning with Official Name-Safety Criteria Throughout Development, 2024, https://www.fda.gov/drugs/medication-errors-related-cder-regulated-drug-products/update-phonetic-and-orthographic-computer-analysis-tool