Blog
Agilización de la autorización de nombres farmacéuticos: Marca unificada y revisión reglamentaria
- Soluciones para Trademarks
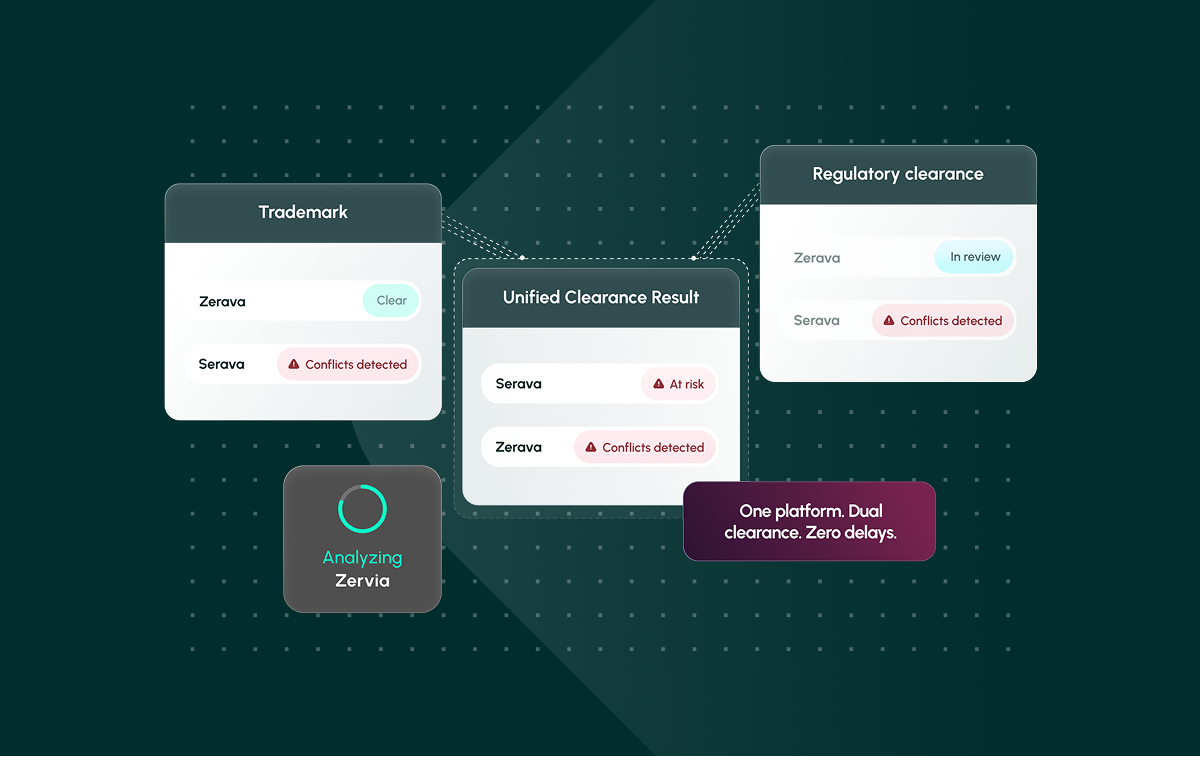
Una plataforma. Doble espacio libre. Cero retrasos. Descubra cómo Corsearch Pharma agiliza la autorización de nombres farmacéuticos.
Poner nombre a una marca farmacéutica nunca ha sido fácil. Con un control más estricto por parte de los organismos reguladores y unos lanzamientos cada vez más competitivos, el riesgo de que un nombre fracase en una fase avanzada del proceso es mayor que nunca.
Este blog explora el doble reto al que se enfrentan los equipos, por qué los enfoques fragmentados tradicionales multiplican los riesgos y las repeticiones, y cómo una estrategia unificada puede ayudar a las empresas a proteger los ingresos, acelerar los plazos de comercialización y salvaguardar la seguridad de los pacientes.
El reto de la doble dificultad
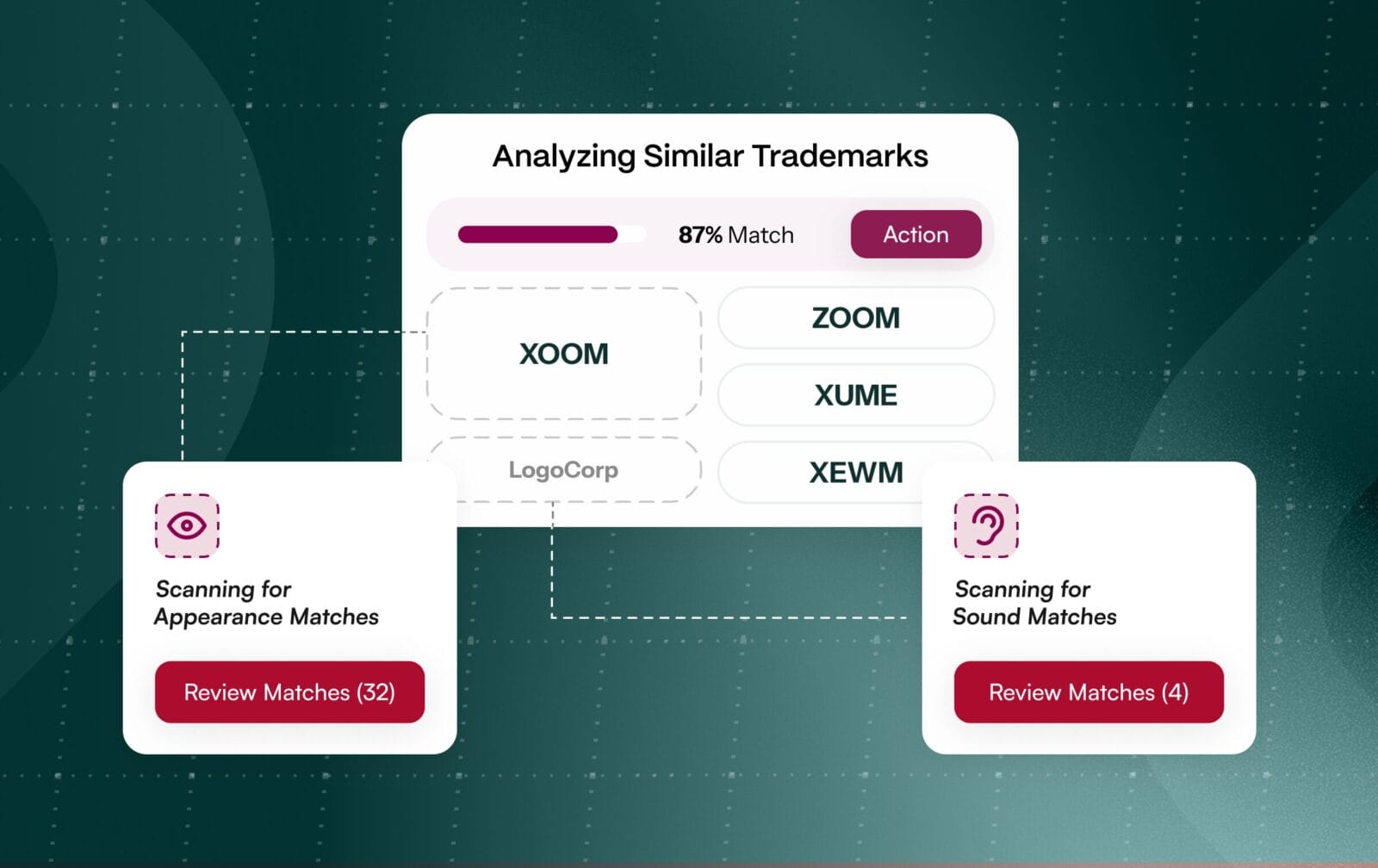
Nombrar una marca farmacéutica no es una tarea lineal. Implica dos revisiones paralelas de alto riesgo. Los equipos jurídicos deben autorizar las marcas en todo el mundo, mientras que los equipos reguladores examinan los nombres en busca de riesgos para la seguridad del paciente, como la confusión por similitud fonética o sonora (LASA). Los organismos reguladores evalúan explícitamente la similitud fonética y ortográfica utilizando la metodología POCA de la FDA en EE.UU. y criterios comparables en la UE, lo que significa que un nombre puede pasar las comprobaciones legales y sin embargo suspender en seguridad.
Tratarlos como proyectos separados y secuenciales multiplica los riesgos y las repeticiones. A menudo, los equipos descubren los conflictos en una fase avanzada del proceso, lo que obliga a costosos cambios de marca o retrasa los lanzamientos. Un camino mejor es unificar la marca y la autorización reglamentaria desde el primer día, lo que permite a los equipos multidisciplinares colaborar en la misma lista de candidatos y detectar pronto los nombres de alto riesgo. [1]
El coste de la fragmentación: duplicación de esfuerzos, retrasos en los lanzamientos, cambios de marca
Ejecutar la marca y la autorización reglamentaria en sistemas diferentes obliga a los equipos a duplicar las búsquedas, conciliar los datos manualmente e iterar tarde cuando surgen conflictos. Estos retrasos son caros. Análisis independientes estiman que cada día de retraso cuesta entre 0,5 y 0,8 millones de dólares en ventas con receta no realizadas para las principales terapias [2], mientras que investigaciones más amplias utilizan el punto de referencia de 1 millón de dólares al día para las implicaciones del lanzamiento [3]. [3] Los pequeños retrasos se traducen en pérdidas materiales de ingresos y en la pérdida de oportunidades de mercado.
Al combinar el análisis jurídico y normativo en una sola interfaz, las organizaciones pueden eliminar la duplicación de esfuerzos, acelerar la toma de decisiones y reducir la exposición al riesgo normativo y de marca.
Por qué a menudo se aprueba lo legal y se suspende en seguridad
Los revisores reguladores comprueban activamente el riesgo de LASA utilizando POCA y listas de comprobación estructuradas en bases de datos de referencia de medicamentos como Drugs@FDA y RxNorm. Los nombres que se parecen o suenan como productos existentes, incluso si son de marca registrada, invitan al rechazo para proteger a los pacientes de errores de medicación. [4] La OMS y los organismos reguladores señalan sistemáticamente el LASA como una amenaza persistente para la seguridad. [5]
La incorporación de la puntuación alineada con POCA y la integración de datos normativos en el proceso de autorización permite a los equipos detectar posibles conflictos en el primer paso de la revisión. Al reflejar las comprobaciones de similitud estructuradas que utilizan los revisores de la FDA y la EMA, las organizaciones pueden eliminar de forma proactiva los nombres no conformes, lo que reduce la probabilidad de sorpresas en las últimas fases y costosas repeticiones del trabajo.
El volumen y la saturación amplifican el riesgo
La mayoría de los programas de nombres generan cientos o incluso miles de candidatos antes de que unos pocos sobrevivan a la presentación. Sin datos integrados ni automatización, los equipos pierden ciclos examinando nombres que, en última instancia, fracasarán por similitud normativa o señales de seguridad. Cada candidato adicional aumenta la complejidad de las revisiones y la probabilidad de que se pasen por alto conflictos [6]. [6]
Un enfoque de selección de alto volumen basado en IA ayuda a los equipos a centrarse en los candidatos más prometedores, reduciendo el esfuerzo desperdiciado y liberando recursos para decisiones creativas y estratégicas de mayor valor.
Cómo es "unificado" y por qué gana
Una plataforma moderna basada en IA debe reunir todos los conjuntos de datos relevantes para la autorización de nombres farmacéuticos: registros de marcas, derecho consuetudinario, datos de dominios y fuentes reguladoras, como el Libro Naranja, Drugs@FDA, RxNorm y las directrices de la EMA.
Los métodos alineados con los reguladores están integrados de forma nativa, incluida la puntuación de similitud estilo POCA y la heurística LASA, por lo que los posibles conflictos se marcan en la primera pasada de selección. El triaje basado en IA agrupa los candidatos que se parecen y los que suenan igual, priorizando por riesgo para agilizar las revisiones y reducir la conciliación manual.
Por último, los resultados deben estandarizarse en un único informe exportable en el que puedan confiar los equipos jurídicos, reguladores y de marketing. La colaboración, las anotaciones y las pruebas listas para la auditoría ayudan a las organizaciones a pasar de la "esperanza de que se autorice" a la confianza rápida, una capacidad que ofrece Corsearch Pharma, que reúne la autorización de marcas y la autorización reglamentaria en una única plataforma integrada.
Resultados empresariales cuantificables
Mediante el uso de Corsearch Pharma, los equipos jurídicos, normativos y de marketing pueden lograr mejoras cuantificables en la eficacia de la autorización, la reducción de riesgos y el ahorro de costes.
Menos rechazos tardíos al resolver conjuntamente los conflictos legales y normativos, reduciendo los bucles de "vuelta al creativo" que disparan los costes del cambio de marca y deslizan los plazos.
Mayor rapidez en la toma de decisiones al eliminar las búsquedas duplicadas y la conciliación manual. Cada día ahorrado protege los ingresos (rangos recientes: entre 0,5 y 0,8 millones de dólares diarios en ventas de recetas no realizadas). [2]
Disminuir el coste total del nombramiento al descartar antes las empresas no prometedoras y reducir las rondas de revisión externa y el riesgo de litigios tras el lanzamiento.
Cómo hacer operativo un enfoque unificado este trimestre
Los equipos pueden implementar un flujo de trabajo unificado y eficiente desde el primer día con Corsearch Pharma, garantizando que la marca registrada y la autorización reglamentaria estén alineadas y sean procesables.
Inicio unificado en la admisión: Ejecute conflictos de marcas y comprobaciones de similitud alineadas con la LPL en la misma lista de candidatos y clasifique por riesgo compuesto.
Pasarela con criterios compartidos: Alinear los umbrales legales y reglamentarios con las mejores prácticas de la FDA y las directrices de la EMA para que los equipos interfuncionales realicen el triaje basándose en pruebas idénticas. [4]
Instrumentar el bucle: Realice un seguimiento de los tiempos de ciclo desde la ideación hasta la preselección. Cuantifique los días ahorrados y los nombres rechazados evitados para demostrar la rentabilidad a los directivos. Utilice el tiempo ahorrado multiplicado por los ingresos diarios en riesgo para modelizar el impacto. [2]
Agilizar y hacer más segura la autorización de nombres farmacéuticos
La nomenclatura farmacéutica no es sólo un problema de marcas comerciales o de regulación. Son ambos. Los procesos fragmentados garantizan la repetición del trabajo. Corsearch Pharma es la primera solución específica del sector que unifica la autorización de marcas y la normativa en una sola plataforma, lo que permite a los equipos jurídicos, normativos y de marketing proteger los ingresos, la seguridad de los pacientes y la inversión creativa, al tiempo que se aceleran los lanzamientos.
Gracias a la puntuación POCA flexible, los datos normativos integrados, el cribado asistido por IA y las funciones de colaboración adaptadas a los entornos regulados, los equipos pueden pasar del "espero que pase" a la confianza con rapidez.
Hablemos
Descubra lo que Corsearch Pharma puede hacer por usted. Hable con uno de nuestros expertos y vea una demostración adaptada a las necesidades de su equipo farmacéutico.
Referencias
[1] U.S. Food and Drug Administration, Best Practices in Developing Proprietary Names for Human Prescription Drug Products, 2020, https://www.fda.gov/regulatory-information/search-fda-guidance-documents/best-practices-developing-proprietary-names-human-prescription-drug-products-guidance-industry.
[2] Applied Clinical Trials Online, ¿Cuánto cuesta realmente un día de retraso en un ensayo clínico?, Tufts CSDD, 2024, https://www.appliedclinicaltrialsonline.com/view/how-much-does-a-day-of-delay-in-a-clinical-trial-really-cost- .
[3] Universidad de Texas en Austin, Benchmarking the Cost of Delayed Drug Launches, 2023, https://repositories.lib.utexas.edu/bitstreams/5306e329-39d9-4af3-8b37-9f46000e3112/download.
[4] U.S. Food and Drug Administration, Phonetic and Orthographic Computer Analysis (POCA) Program, 2024, https://www.fda.gov/drugs/resources-drugs/phonetic-and-orthographic-computer-analysis-poca-program.
[5] Organización Mundial de la Salud, Medication Safety for Look-Alike, Sound-Alike Medicines, 2023, https://www.who.int/publications/i/item/9789240058897.
[6] U.S. Food and Drug Administration / European Medicines Agency, Guidance on Aligning with Official Name-Safety Criteria Throughout Development, 2024, https://www.fda.gov/drugs/medication-errors-related-cder-regulated-drug-products/update-phonetic-and-orthographic-computer-analysis-tool.