Blog
Semplificare l'autorizzazione dei nomi farmaceutici: Revisione unificata di marchi e normative
- Soluzioni per i marchi
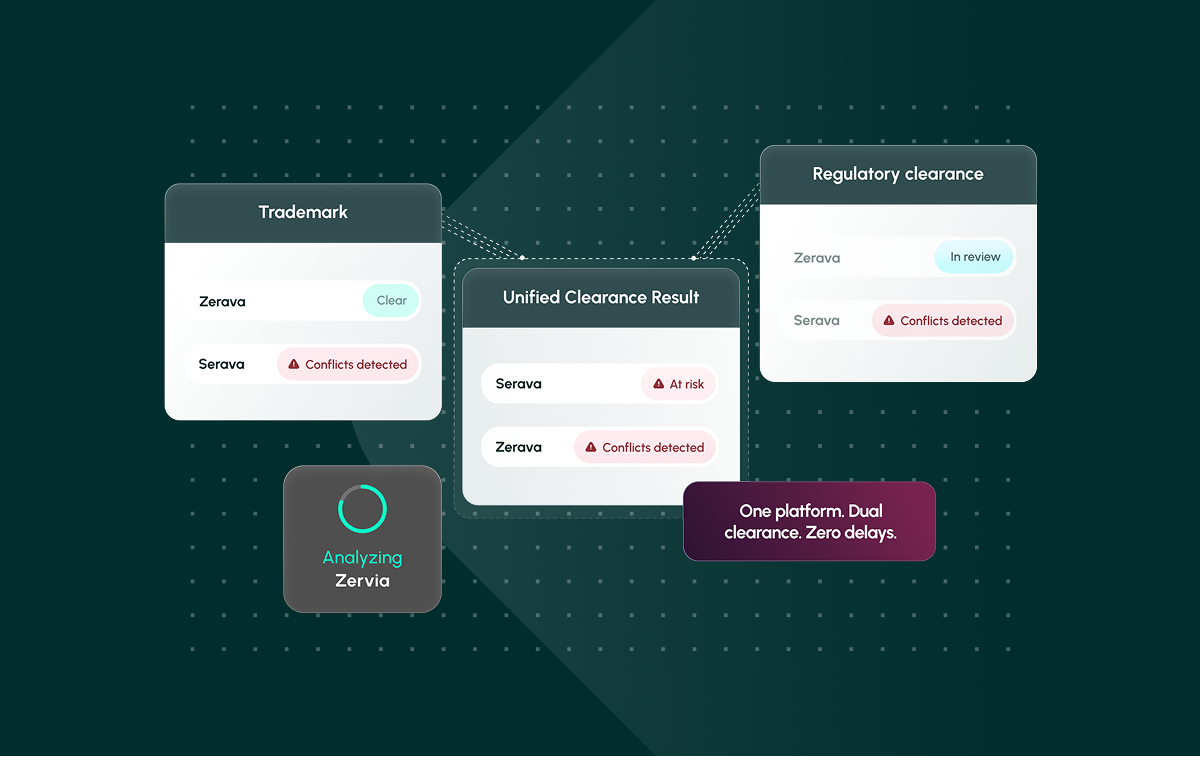
Una piattaforma. Doppia autorizzazione. Zero ritardi. Scoprite come Corsearch Pharma semplifica l'autorizzazione dei nomi farmaceutici.
La scelta dei nomi dei marchi farmaceutici non è mai stata facile. Con l'inasprimento dei controlli da parte delle autorità di regolamentazione e la crescente competitività dei lanci, il rischio che un nome fallisca in una fase avanzata del processo è più alto che mai.
Questo blog esplora le duplici sfide che i team devono affrontare, il motivo per cui i tradizionali approcci frammentati moltiplicano i rischi e le rielaborazioni e il modo in cui una strategia unificata può aiutare le aziende a proteggere i ricavi, accelerare il time-to-market e salvaguardare la sicurezza dei pazienti.
La sfida del doppio gioco
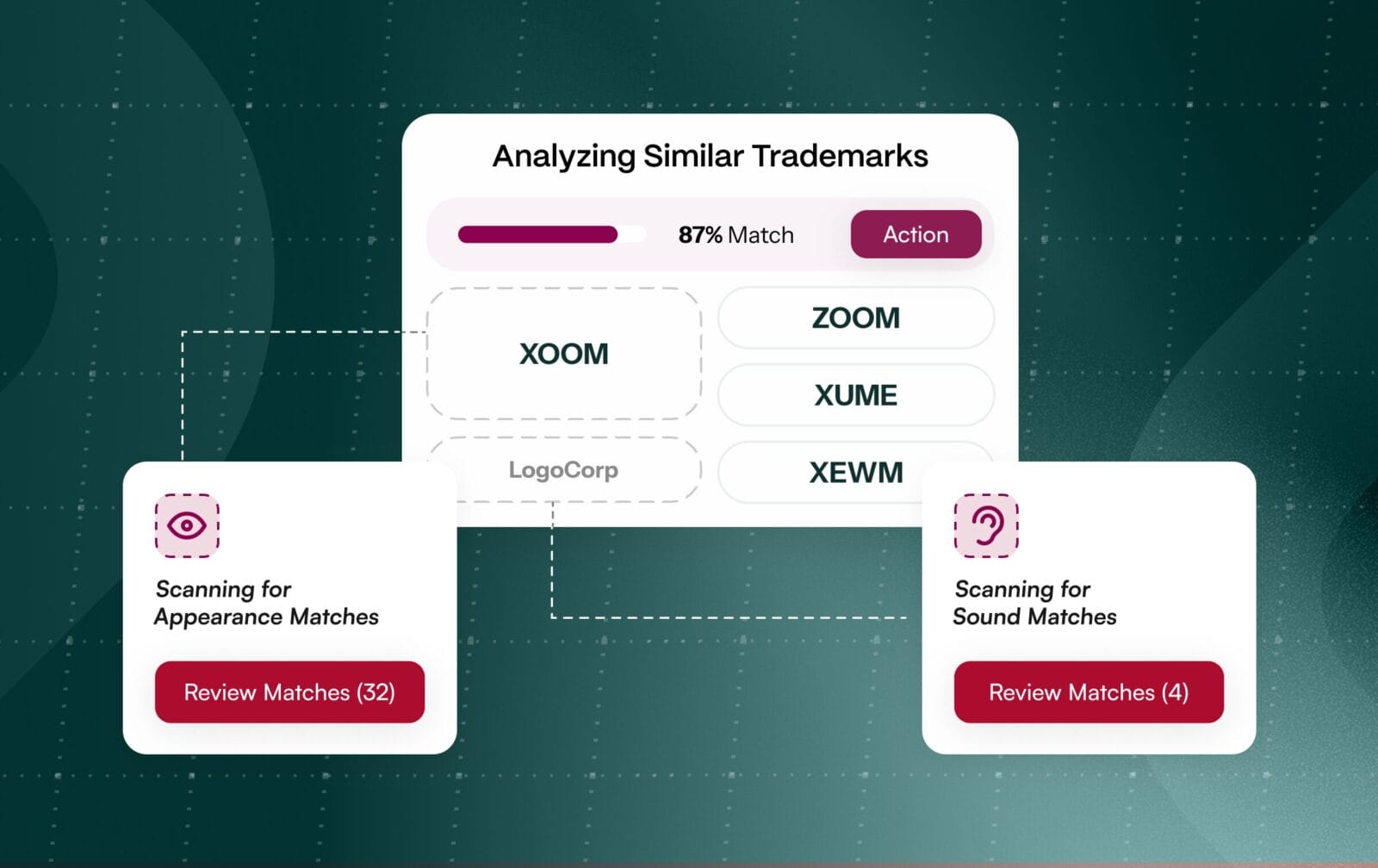
La denominazione di un marchio farmaceutico non è un compito lineare. Comporta due revisioni parallele e ad alto rischio. I team legali devono autorizzare i marchi a livello globale, mentre i team normativi esaminano i nomi alla ricerca di rischi per la sicurezza del paziente, come la confusione tra somiglianza e suono (LASA). Le autorità di regolamentazione valutano esplicitamente la somiglianza fonetica e ortografica utilizzando la metodologia POCA della FDA negli Stati Uniti e criteri analoghi nell'Unione Europea, il che significa che un nome può superare i controlli legali ma non superare quelli di sicurezza.
Trattarli come progetti separati e sequenziali moltiplica i rischi e le rielaborazioni. Spesso i team scoprono conflitti in ritardo, costringendo a costosi rebranding o ritardando il lancio. Un percorso migliore consiste nell'unificare le autorizzazioni per i marchi e le normative fin dal primo giorno, consentendo ai team interfunzionali di collaborare sullo stesso elenco di candidati e di segnalare tempestivamente i nomi ad alto rischio. [1]
Il costo della frammentazione: sforzi duplicati, lanci ritardati, rebranding
La gestione dei marchi e delle autorizzazioni normative su sistemi diversi costringe i team a duplicare le ricerche, a riconciliare i dati manualmente e a iterare in ritardo quando emergono conflitti. Questi ritardi sono costosi. Analisi indipendenti stimano che ogni giorno di slittamento costa 0,5 milioni di dollari - 0,8 milioni di dollari in vendite non realizzate per le principali terapie, [2] mentre una ricerca più ampia utilizza un parametro di 1 milione di dollari al giorno per le implicazioni del lancio. [Piccoli slittamenti temporali si traducono in perdite sostanziali di fatturato e in mancate finestre di mercato.
Combinando lo screening legale e normativo in un'unica interfaccia, le organizzazioni possono eliminare le duplicazioni, accelerare il processo decisionale e ridurre l'esposizione al rischio normativo e di marchio.
Perché "passare per la legge, fallire per la sicurezza" accade spesso
I revisori normativi verificano attivamente il rischio LASA utilizzando POCA e liste di controllo strutturate su database di riferimento per i farmaci come Drugs@FDA e RxNorm. I nomi che assomigliano o suonano come prodotti esistenti, anche se con un marchio distintivo, sono da respingere per proteggere i pazienti da errori di medicazione. [4] L'OMS e le autorità di regolamentazione segnalano costantemente i LASA come una minaccia persistente per la sicurezza. [5]
L'integrazione del punteggio allineato al POCA e dei dati normativi nel processo di autorizzazione consente ai team di individuare i potenziali conflitti al primo passaggio di screening. Rispecchiando i controlli di somiglianza strutturati utilizzati dai revisori di FDA ed EMA, le organizzazioni possono eliminare in modo proattivo i nomi non conformi, riducendo la probabilità di sorprese in fase avanzata e di costose rielaborazioni.
Volume e saturazione amplificano il rischio
La maggior parte dei programmi di denominazione genera centinaia o addirittura migliaia di candidati prima che alcuni sopravvivano alla presentazione. In assenza di dati integrati e di automazione, i team sprecano cicli di analisi di nomi che in ultima analisi non saranno accettati in base alla somiglianza con le normative o ai segnali di sicurezza. Ogni candidato in più aumenta la complessità delle revisioni e la probabilità di conflitti mancati. [6]
Un approccio di screening ad alto volume e guidato dall'intelligenza artificiale aiuta i team a concentrarsi sui candidati più promettenti, riducendo gli sprechi e liberando risorse per decisioni creative e strategiche di maggior valore.
Che aspetto ha l'"unificato" e perché è vincente
Una piattaforma moderna e abilitata all'AI dovrebbe riunire tutti i set di dati rilevanti per l'autorizzazione dei nomi farmaceutici: registri dei marchi, common law, dati di dominio e fonti delle autorità di regolamentazione, tra cui l'Orange Book, Drugs@FDA, RxNorm e le linee guida dell'EMA.
I metodi allineati alle autorità di regolamentazione sono integrati in modo nativo, compresi il punteggio di similarità in stile POCA e l'euristica LASA, in modo che i potenziali conflitti vengano segnalati al primo passaggio di screening. Il triage guidato dall'intelligenza artificiale raggruppa i candidati simili e simili, stabilendo una priorità in base al rischio per snellire le revisioni e ridurre la riconciliazione manuale.
Infine, i risultati devono essere standardizzati in un unico report esportabile di cui i team legali, normativi e di marketing possano fidarsi. La collaborazione, l'annotazione e le prove pronte per l'audit aiutano le organizzazioni a passare dalla "speranza di ottenere l'autorizzazione" alla fiducia in tempi rapidi, una capacità offerta da Corsearch Pharma, che riunisce l'autorizzazione dei marchi e delle normative in un'unica piattaforma integrata.
Risultati aziendali quantificabili
Utilizzando Corsearch Pharma, i team legali, normativi e di marketing possono ottenere miglioramenti misurabili in termini di efficienza delle autorizzazioni, riduzione dei rischi e risparmio sui costi.
Meno rifiuti tardivi risolvendo insieme i conflitti legali e normativi, riducendo i cicli di "ritorno alla creatività" che innescano costi di rebrand e fanno slittare i tempi.
Tempi di decisione più rapidi grazie all'eliminazione delle ricerche doppie e della riconciliazione manuale. Ogni giorno risparmiato protegge le entrate (intervalli recenti: 0,5 milioni di dollari - 0,8 milioni di dollari al giorno in vendite di prescrizioni non realizzate). [2]
Riduzione del costo totale del naming grazie all'eliminazione anticipata dei progetti non avviati e alla riduzione dei cicli di revisione esterna e del rischio di contenzioso dopo il lancio.
Come rendere operativo un approccio unificato in questo trimestre
I team possono implementare un flusso di lavoro unificato ed efficiente fin dal primo giorno con Corsearch Pharma, assicurando che il marchio e l'autorizzazione normativa siano allineati e attuabili.
Avviare l'unificazione all'ingresso: Eseguire controlli sui conflitti di marchio e sulla somiglianza con il POCA sullo stesso elenco di candidati e classificare in base al rischio composito.
Gateing con criteri condivisi: Allineare le soglie legali e normative alle best practice della FDA e alle linee guida dell'EMA, in modo che i team interfunzionali effettuino il triage su prove identiche. [4]
Strumentate il ciclo: Tracciare i tempi del ciclo dall'ideazione alla shortlist. Quantificare i giorni risparmiati e i nomi rifiutati evitati per dimostrare il ROI alla leadership. Utilizzare il tempo risparmiato moltiplicato per le entrate giornaliere a rischio per modellare l'impatto. [2]
Rendere più veloce e sicura l'autorizzazione dei nomi farmaceutici
La denominazione farmaceutica non è solo un problema di marchio o di regolamentazione. Si tratta di entrambe le cose. I processi frammentati garantiscono una rielaborazione. Corsearch Pharma è la prima soluzione specifica per il settore a unificare le autorizzazioni per i marchi e le normative in un'unica piattaforma, consentendo ai team legali, normativi e di marketing di proteggere i ricavi, la sicurezza dei pazienti e gli investimenti creativi, accelerando al contempo i lanci.
Grazie alla flessibilità del punteggio POCA, ai dati normativi integrati, allo screening assistito dall'intelligenza artificiale e alle funzionalità di collaborazione adattate agli ambienti regolamentati, i team possono passare dalla "speranza che sia approvato" alla fiducia in tempi rapidi.
Parliamo
Scoprite cosa può fare Corsearch Pharma per voi. Parlate con uno dei nostri esperti e assistete a una demo personalizzata per le esigenze del vostro team farmaceutico.
Riferimenti
[1] U.S. Food and Drug Administration, Best Practices in Developing Proprietary Names for Human Prescription Drug Products, 2020, https://www.fda.gov/regulatory-information/search-fda-guidance-documents/best-practices-developing-proprietary-names-human-prescription-drug-products-guidance-industry.
[2] Applied Clinical Trials Online, How Much Does a Day of Delay in a Clinical Trial Really Cost?, Tufts CSDD, 2024, https://www.appliedclinicaltrialsonline.com/view/how-much-does-a-day-of-delay-in-a-clinical-trial-really-cost-
[3] Università del Texas ad Austin, Benchmarking the Cost of Delayed Drug Launchches, 2023, https://repositories.lib.utexas.edu/bitstreams/5306e329-39d9-4af3-8b37-9f46000e3112/download
[4] U.S. Food and Drug Administration, Phonetic and Orthographic Computer Analysis (POCA) Program, 2024, https://www.fda.gov/drugs/resources-drugs/phonetic-and-orthographic-computer-analysis-poca-program
[5] Organizzazione Mondiale della Sanità, Medication Safety for Look-Alike, Sound-Alike Medicines, 2023, https://www.who.int/publications/i/item/9789240058897
[6] U.S. Food and Drug Administration / European Medicines Agency, Guidance on Aligning with Official Name-Safety Criteria Throughout Development, 2024, https://www.fda.gov/drugs/medication-errors-related-cder-regulated-drug-products/update-phonetic-and-orthographic-computer-analysis-tool