Blog
Vereinfachung der Freigabe von Pharmanamen: Vereinheitlichte Prüfung von Markenzeichen und Zulassungen
- Lösungen für Markenzeichen
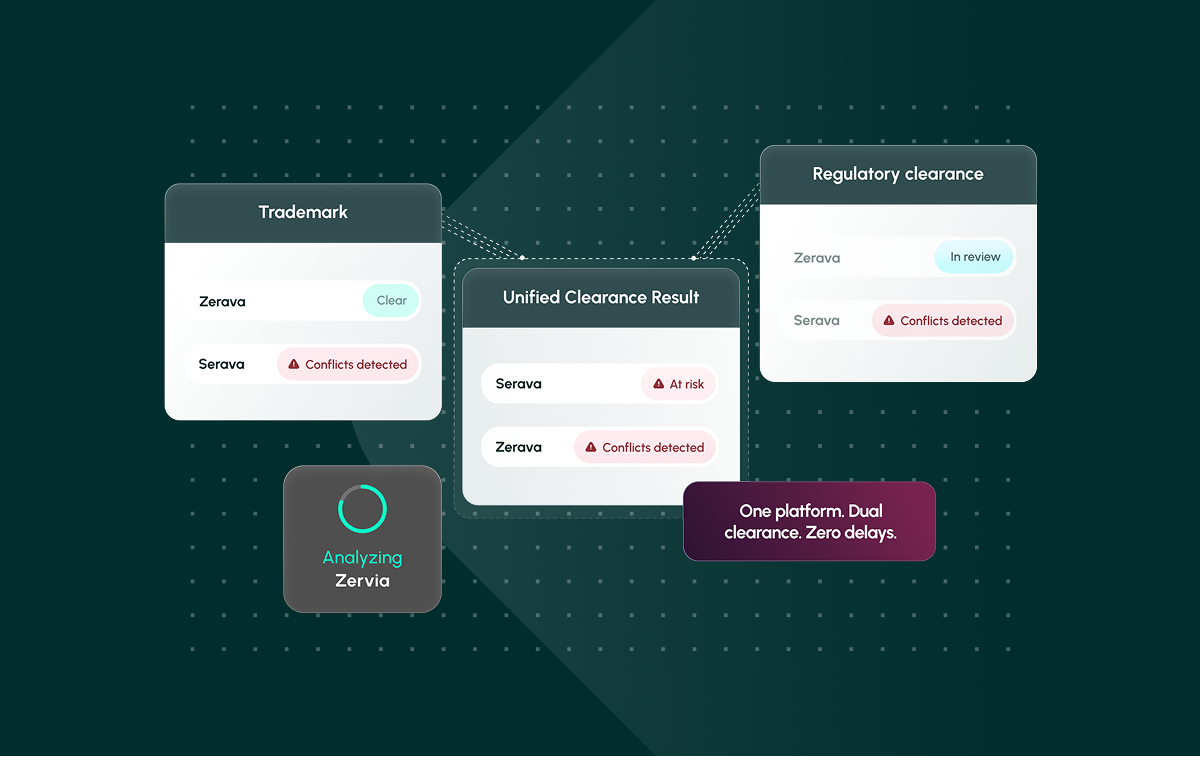
Eine Plattform. Doppelte Freigabe. Keine Verzögerungen. Erfahren Sie, wie Corsearch Pharma die Freigabe pharmazeutischer Namen rationalisiert.
Die Namensgebung für pharmazeutische Marken war noch nie einfach. Da die Aufsichtsbehörden ihre Kontrollen verschärfen und die Markteinführung immer wettbewerbsintensiver wird, ist das Risiko, dass ein Name in einem späten Stadium des Prozesses scheitert, höher denn je.
Dieser Blog befasst sich mit den doppelten Herausforderungen, mit denen Teams konfrontiert sind, und damit, warum herkömmliche fragmentierte Ansätze das Risiko und die Nacharbeit vervielfachen und wie eine einheitliche Strategie Unternehmen dabei helfen kann, ihre Einnahmen zu schützen, die Markteinführung zu beschleunigen und die Patientensicherheit zu gewährleisten.
Die Herausforderung der Doppelhürde
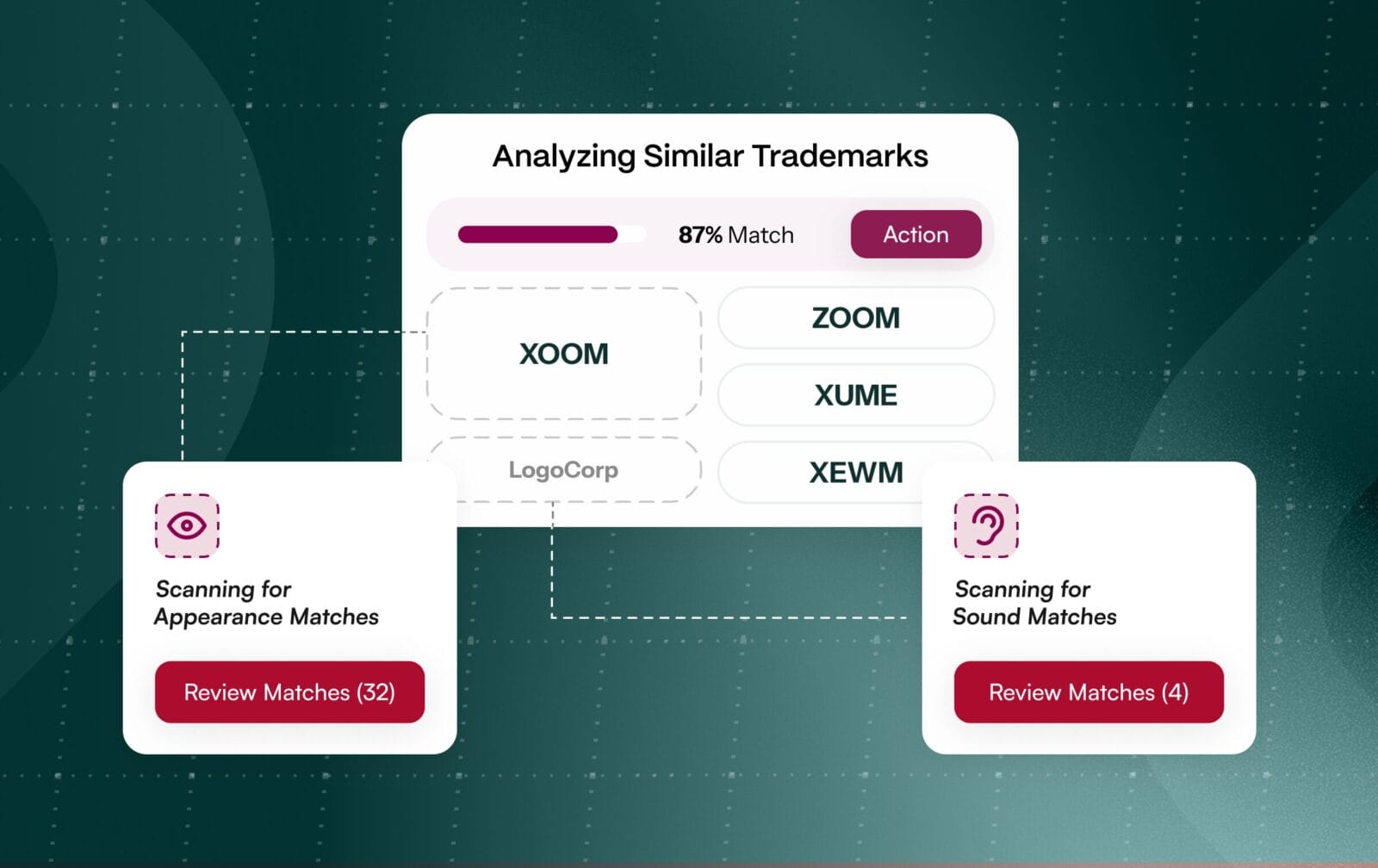
Die Namensgebung für pharmazeutische Marken ist keine lineare Aufgabe. Es handelt sich um zwei parallele Überprüfungen, bei denen viel auf dem Spiel steht. Die Rechtsteams müssen die Marken weltweit freigeben, während die Teams der Aufsichtsbehörden die Namen auf Risiken für die Patientensicherheit prüfen, z. B. auf Verwechslungen durch ähnliche oder gleich klingende Namen (Look-alike or Sound-alike, LASA). Die Aufsichtsbehörden bewerten ausdrücklich die phonetische und orthografische Ähnlichkeit anhand der POCA-Methode der FDA in den USA und vergleichbarer Kriterien in der EU, was bedeutet, dass ein Name zwar die rechtlichen Prüfungen bestehen, aber dennoch bei der Sicherheit versagen kann.
Die Behandlung dieser Projekte als separate, aufeinanderfolgende Projekte vervielfacht das Risiko und die Nacharbeit. Die Teams entdecken Konflikte oft erst spät im Prozess, was zu kostspieligen Markenumbenennungen führt oder die Markteinführung verzögert. Ein besserer Weg ist die Vereinheitlichung der Marken- und Zulassungsgenehmigung vom ersten Tag an, so dass funktionsübergreifende Teams an derselben Kandidatenliste zusammenarbeiten und Namen mit hohem Risiko frühzeitig erkennen können. [1]
Die Kosten der Fragmentierung: doppelter Aufwand, verzögerte Markteinführung, Markenwechsel
Die Durchführung von Marken- und behördlichen Genehmigungsverfahren in verschiedenen Systemen zwingt die Teams dazu, Suchvorgänge zu duplizieren, Daten manuell abzugleichen und bei Konflikten zu spät zu wiederholen. Diese Verzögerungen sind teuer. Unabhängige Analysen schätzen, dass jeder Tag Verzögerung zwischen 0,5 und 0,8 Millionen Dollar an nicht realisierten verschreibungspflichtigen Umsätzen für wichtige Therapien kostet [2], während breitere Forschungen den Richtwert von 1 Million Dollar pro Tag für die Auswirkungen einer Markteinführung verwenden. [3] Kleine Zeitverschiebungen führen zu erheblichen Umsatzverlusten und verpassten Marktfenstern.
Durch die Kombination von rechtlichem und regulatorischem Screening in einer Schnittstelle können Unternehmen doppelten Aufwand vermeiden, die Entscheidungsfindung beschleunigen und das Risiko sowohl von regulatorischen als auch von Markenrisiken reduzieren.
Warum "Legal bestehen, Sicherheit nicht bestehen" oft vorkommt
Die Prüfer der Zulassungsbehörden testen aktiv auf das LASA-Risiko, indem sie POCA und strukturierte Checklisten in Arzneimittelreferenzdatenbanken wie Drugs@FDA und RxNorm verwenden. Namen, die wie bereits existierende Produkte aussehen oder klingen, selbst wenn sie markenrechtlich eindeutig sind, werden abgelehnt, um Patienten vor Medikationsfehlern zu schützen. [4] Die WHO und die Regulierungsbehörden weisen immer wieder auf LASA als anhaltendes Sicherheitsrisiko hin. [5]
Durch die Integration von POCA-konformen Bewertungen und regulatorischen Daten in den Freigabeprozess können die Teams potenzielle Konflikte bereits beim ersten Durchlauf erkennen. Durch die Spiegelung der strukturierten Ähnlichkeitsprüfungen, die von FDA- und EMA-Prüfern verwendet werden, können Unternehmen proaktiv nicht konforme Namen ausschließen und so die Wahrscheinlichkeit von Überraschungen in der Spätphase und kostspieliger Nacharbeit verringern.
Lautstärke und Sättigung verstärken das Risiko
Die meisten Namensgebungsprogramme generieren Hunderte oder sogar Tausende von Kandidaten, bevor einige wenige bis zur Einreichung überleben. Ohne integrierte Daten und Automatisierung vergeuden die Teams Zyklen mit der Prüfung von Namen, die letztlich an der Ähnlichkeit mit den Vorschriften oder an Sicherheitssignalen scheitern werden. Jeder zusätzliche Kandidat erhöht die Komplexität der Prüfungen und die Wahrscheinlichkeit, dass Konflikte übersehen werden. [6]
Ein KI-gesteuerter, hochvolumiger Screening-Ansatz hilft den Teams, sich auf die vielversprechendsten Kandidaten zu konzentrieren, wodurch unnötiger Aufwand vermieden und Ressourcen für höherwertige kreative und strategische Entscheidungen freigesetzt werden.
Wie "einheitlich" aussieht und warum sie gewinnt
Eine moderne, KI-gestützte Plattform sollte alle für die Freigabe von Pharmanamen relevanten Datensätze zusammenführen: Markenregister, Gewohnheitsrecht, Domaindaten und regulatorische Quellen wie das Orange Book, Drugs@FDA, RxNorm und EMA-Leitlinien.
An den Regulierungsbehörden ausgerichtete Methoden sind nativ eingebettet, einschließlich POCA-ähnlicher Ähnlichkeitsbewertung und LASA-Heuristiken, sodass potenzielle Konflikte bereits beim ersten Durchgang erkannt werden. Die KI-gesteuerte Triage gruppiert ähnlich aussehende und ähnlich klingende Kandidaten und priorisiert sie nach Risiko, um Überprüfungen zu rationalisieren und den manuellen Abgleich zu reduzieren.
Schließlich sollten die Ergebnisse in einem einzigen, exportierbaren Bericht standardisiert werden, dem die Rechts-, Zulassungs- und Marketingteams vertrauen können. Zusammenarbeit, Anmerkungen und prüfungsreife Nachweise helfen Unternehmen dabei, von der "Hoffnung auf eine Freigabe" zu schnellem Vertrauen zu gelangen - eine Fähigkeit, die Corsearch Pharma bietet, das Marken- und behördliche Freigaben in einer einzigen, integrierten Plattform zusammenführt.
Geschäftsergebnisse, die Sie quantifizieren können
Durch den Einsatz von Corsearch Pharma können Rechts-, Regulierungs- und Marketingteams messbare Verbesserungen bei der Effizienz der Freigabe, der Risikominderung und den Kosteneinsparungen erzielen.
Weniger späte Ablehnungen durch die gemeinsame Lösung rechtlicher und regulatorischer Konflikte, wodurch die "Zurück-zur-Kreation"-Schleifen reduziert werden, die Rebranding-Kosten verursachen und die Zeitpläne verschieben.
Schnellere Entscheidungsfindung, da doppelte Suchvorgänge und manueller Abgleich entfallen. Jeder eingesparte Tag schützt den Umsatz (aktuelle Spanne: $0,5 Mio.-$0,8 Mio. pro Tag an nicht realisierten Rezeptumsätzen). [2]
Senkung der Gesamtkosten für die Namensgebung durch frühzeitiges Aussortieren von Nicht-Startups und Reduzierung der externen Überprüfungsrunden und des Prozessrisikos nach der Markteinführung.
Wie kann ein einheitlicher Ansatz in diesem Quartal umgesetzt werden?
Teams können mit Corsearch Pharma vom ersten Tag an einen einheitlichen, effizienten Arbeitsablauf implementieren, der sicherstellt, dass Marken- und Zulassungsgenehmigungen aufeinander abgestimmt und umsetzbar sind.
Beginnen Sie einheitlich bei der Aufnahme: Führen Sie Markenkonflikte und auf POCA ausgerichtete Ähnlichkeitsprüfungen für dieselbe Kandidatenliste durch und ordnen Sie sie nach dem zusammengesetzten Risiko.
Gate mit gemeinsamen Kriterien: Angleichung der rechtlichen und regulatorischen Schwellenwerte an die bewährten Praktiken der FDA und die Leitlinien der EMA, damit funktionsübergreifende Teams auf der Grundlage identischer Nachweise eine Triage vornehmen. [4]
Instrumentieren Sie den Kreislauf: Verfolgen Sie die Zykluszeiten von der Ideenfindung bis zur Vorauswahl. Quantifizieren Sie die eingesparten Tage und die vermiedenen Ablehnungen, um der Geschäftsleitung den ROI zu demonstrieren. Verwenden Sie die eingesparte Zeit multipliziert mit dem täglichen Umsatzrisiko, um die Auswirkungen zu modellieren. [2]
Schnellere und sicherere Freigabe von Arzneimittelnamen
Die Namensgebung in der Pharmabranche ist nicht nur ein Markenproblem oder ein regulatorisches Problem. Es ist beides. Fragmentierte Prozesse garantieren Nacharbeit. Corsearch Pharma ist die erste branchenspezifische Lösung, die Marken- und Zulassungsfreigaben in einer Plattform vereint und es Rechts-, Zulassungs- und Marketingteams ermöglicht, Einnahmen, Patientensicherheit und kreative Investitionen zu schützen und gleichzeitig die Markteinführung zu beschleunigen.
Mit der flexiblen POCA-Bewertung, den integrierten regulatorischen Daten, dem KI-gestützten Screening und den auf regulierte Umgebungen zugeschnittenen Funktionen für die Zusammenarbeit können die Teams schnell von "Hoffen, dass es genehmigt wird" zu Vertrauen übergehen.
Lassen Sie uns reden
Finden Sie heraus, was Corsearch Pharma für Sie tun kann. Sprechen Sie mit einem unserer Experten und sehen Sie sich eine Demo an, die auf die Bedürfnisse Ihres Pharma-Teams zugeschnitten ist.
Verweise
[1] U.S. Food and Drug Administration, Best Practices in Developing Proprietary Names for Human Prescription Drug Products, 2020, https://www.fda.gov/regulatory-information/search-fda-guidance-documents/best-practices-developing-proprietary-names-human-prescription-drug-products-guidance-industry
[2] Applied Clinical Trials Online, How Much Does a Day of Delay in a Clinical Trial Really Cost?, Tufts CSDD, 2024, https://www.appliedclinicaltrialsonline.com/view/how-much-does-a-day-of-delay-in-a-clinical-trial-really-cost-
[3] The University of Texas at Austin, Benchmarking the Cost of Delayed Drug Launches, 2023, https://repositories.lib.utexas.edu/bitstreams/5306e329-39d9-4af3-8b37-9f46000e3112/download
[4] U.S. Food and Drug Administration, Phonetic and Orthographic Computer Analysis (POCA) Program, 2024, https://www.fda.gov/drugs/resources-drugs/phonetic-and-orthographic-computer-analysis-poca-program
[5] Weltgesundheitsorganisation, Medication Safety for Look-Alike, Sound-Alike Medicines, 2023, https://www.who.int/publications/i/item/9789240058897
[6] U.S. Food and Drug Administration / European Medicines Agency, Guidance on Aligning with Official Name-Safety Criteria Throughout Development, 2024, https://www.fda.gov/drugs/medication-errors-related-cder-regulated-drug-products/update-phonetic-and-orthographic-computer-analysis-tool